媒體提問,國產疫苗尚未完成臨床第三期試驗,未來如何取得國際認可?另,有檢察官認為,既然政府已與國內廠商簽約,應應公布購買疫苗價格。陳時中回應,與上市公司簽約有保密條款,檢察官若認為有需要可去訊問,但指揮中心不關心對市場的影響,只在乎廠商的臨床試驗有無照標準規格,以及解盲結果等,要以此做為緊急授權參考。
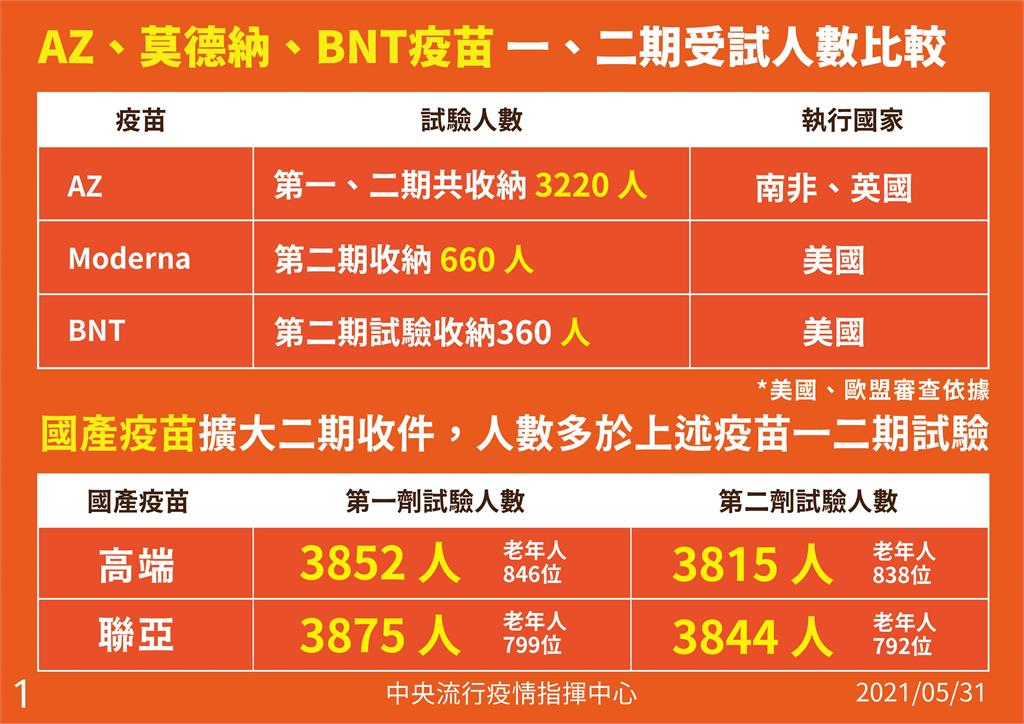
對於國產疫苗安全性受質疑,陳時中列出國外與國產疫苗的第一期、第二期受試人數比較,可見國產疫苗擴大第二期收件,人數多於國外疫苗的第一、二期試驗人數總和。他以聯亞第二期試驗人數為例,3844人中高齡人口有792名,顯然比國外數目來得大很多,可視為第二、三期的延續計畫,所以二期如能通過,安全性就不會有問題。
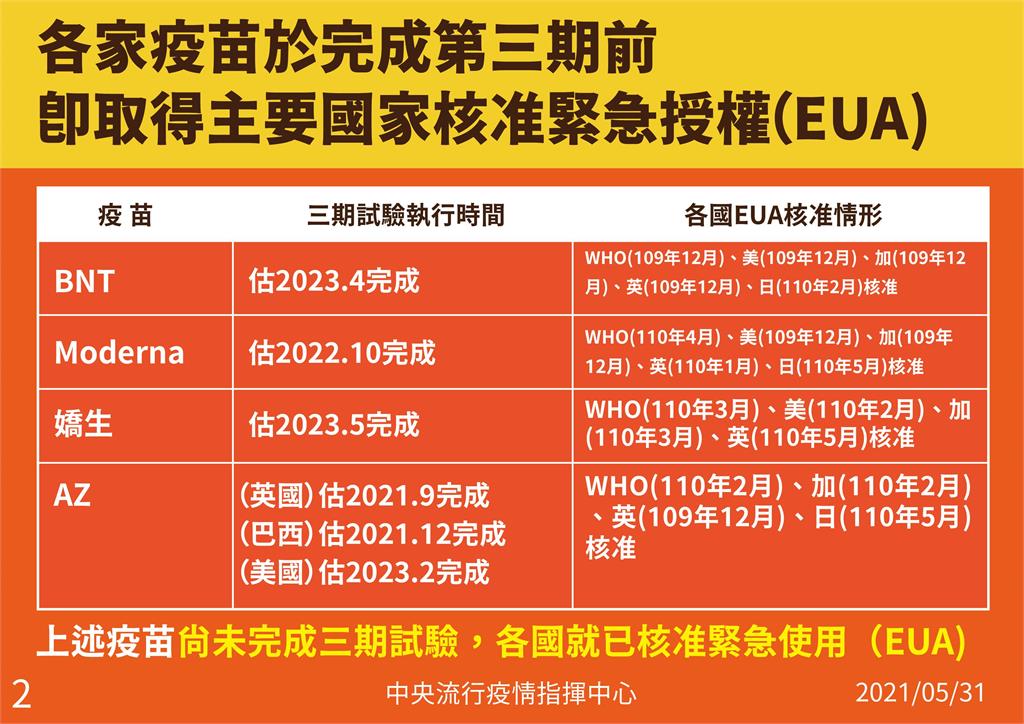
至於大家都在講各國緊急授權是何時通過、是否都做完第三期?陳時中直言,三期的實驗大部分時間拉很長,等到三期完畢後才來做決定恐怕緩不濟急。
陳時中,再度秀出國產與國外疫苗的比較圖表,可見BNT若要完整做完第三期,預估要到2023年4月;莫德納是2022年10月;嬌生是2023年5月;AZ較快一點,在英國的話於2021年9月,但這4支疫苗都在去年與今年陸續獲得世界衛生組織(WHO)與美加等國的緊急授權,「這時候就是二期做完,三期沒有完」。
陳時中重申,等到疫情完畢,三期結果才出來,恐怕真的是緩不濟急。
(民視新聞網/綜合報導)
更多新聞: 快新聞/未過三期就預採購疫苗惹議 周志浩:有2大好處