聯亞疫苗,選在週日傍晚宣布,武漢肺炎疫苗二期臨床試驗期中分析結果,在安全和耐受性部份數據,全都顯示良好。
聯亞藥發言人范瀛云表示,「分析結果顯示安全性與耐受性良好,所有受試者未出現嚴重不良反應,並規劃在今年11月中下旬,進行試驗解盲。」
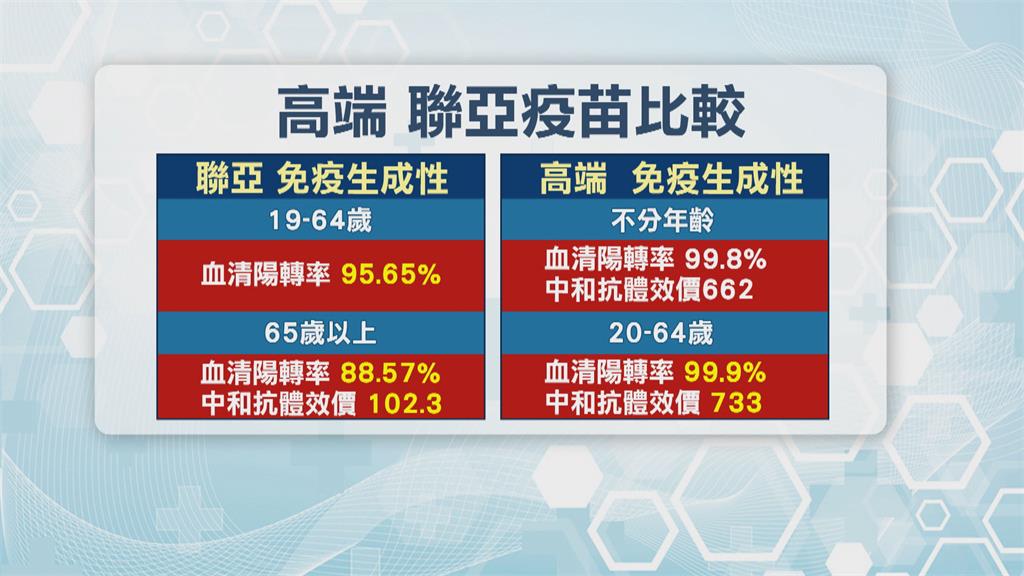
解盲還得等11月,但聯亞藥公布各項臨床數據,免疫生成性在19到64歲中,血清陽轉率高達95.65%,65歲以上血清陽轉率也有88.57%,中和抗體效價則是102.3;前兩項數據和另一家國產疫苗高端,相去不遠.中和抗體效價部分,高端略勝一籌,安全性方面,兩家國產疫苗均優於mRNA和腺病毒疫苗。
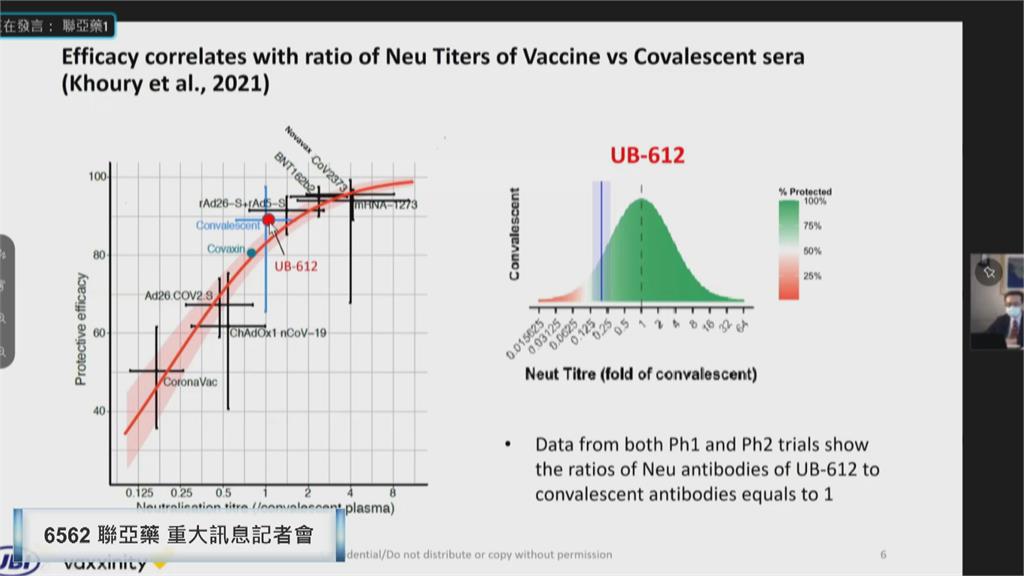
聯亞藥發言人范瀛云表示,「於變異株有效保護力的部分,UB612誘導出的中和性抗體,對印度delta株的效價,仍保持同一個水平。」
聯亞強調,自家疫苗可以對抗Delta突變株,二期臨床試驗數據,雖然不含保護力,但發言人根據恢復期病人血清、病毒綜合實驗分析,做出推估。
聯亞生技營運長彭文君表示,「幾個平均數字都在這個位置,所以我們跟他對比是1點多,1點多表示說換算出來,這邊的保護力應該是將近80,保護力應該還算是不錯,具有全面性保護作用。」
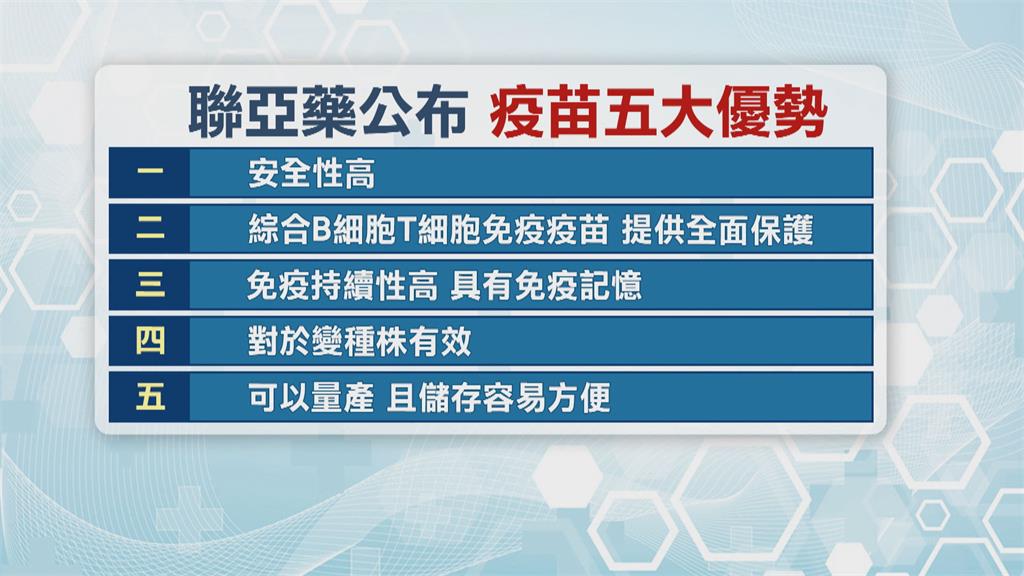
不只能對Delta和各種變種株,都有效,聯亞更說明五大優勢,疫苗安全性更高、免疫持續性高,也不用超低溫保存,比輝瑞、嬌生更具優勢。六月底將送件食藥署,申請EUA緊急授權.同時會加速到印度進行第三期萬人實驗。

聯亞傳出好消息,高端疫苗則是發出重訊,反駁中天網路新聞,指控CNN沒穿防護衣沒戴口罩,更形容高端像家庭代工。對此高端也發重訊澄清,強調生產操作皆嚴格依循GMP規範進業,公司已委請律師發存證信函,要求更正不實報導。
(民視新聞/綜合報導)
更多新聞: 「紓困4.0」後小店家「看得到吃不到」 鄭寶清呼籲儘速補漏