國鼎生技一級主管排排坐,公布武漢肺炎口服新藥,二期臨床試驗解盲數據。董事長劉勝勇,自認結果已經達標,解盲成功。
國鼎生技董事長劉勝勇說,「是的我們可以說是達標,而且是一個口服藥,在治療新冠肺炎時,我們認為是相當了不起。」
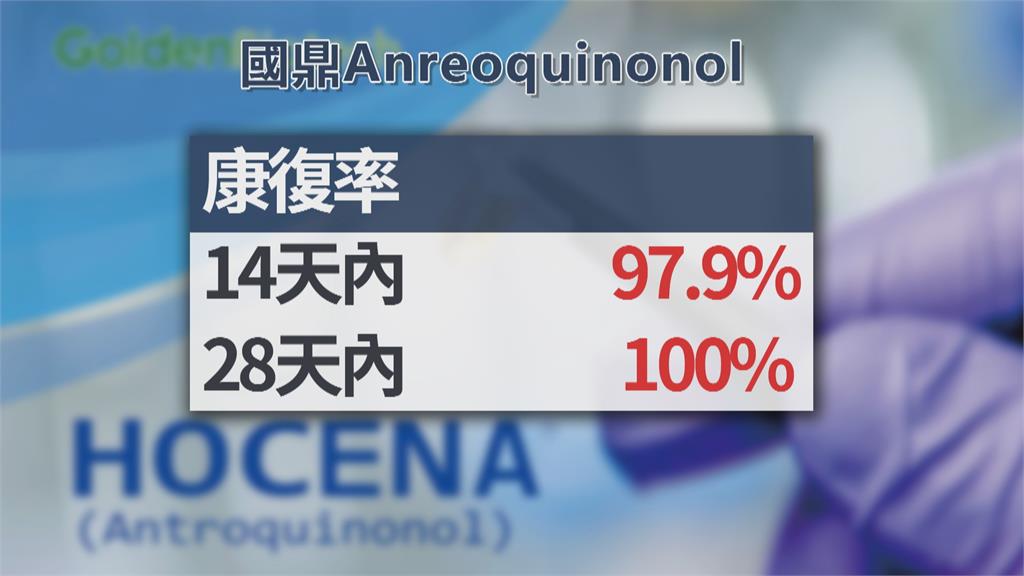
國鼎在美國、南美,收治124位住院病患,主要評估指標「康復率」。在第14天內達到97.9%,第28天無人死亡、呼吸衰竭,康復率100%;ICU重症病人治療時間,縮短9.5天。住院時間,中位數是4天,比安慰劑組縮短20%,清除病毒時間,大約14天。國鼎將在3月送出報告,向美國FDA申請EUA。

國鼎生技總經理蘇經天說,「大概四月份會csr有報告,我們一直催促他們是不是能三月,跟FDA申請EUA事前會議,來跟他們做討論,如果也得到他們同意,就會進行申請。」
希望最快4月能拿到美國緊急授權,三期臨床試驗,將延續二期設計,不過,會納入突破性感染,收案人數增加到五、六百人。
國鼎生技董事長劉勝勇說,「三期臨床就會包括歐洲,新加坡韓國都會納入,我們臨床中心會擴大到50個臨床中心以上,才可以比較快的方式來收案。」
目前美國只通過輝瑞、默沙東兩款口服藥物緊急授權,國鼎有機會成為第三家。
陳時中也對國鼎新藥「抱持期待」,並提醒在美國通過EUA後,也可以此再向台灣申請,能避免走太多重複的路。
(民視新聞/林嘉玫、郭南宏 台北報導)
更多新聞: 通膨時代樣樣漲!內行曝速食店「2點餐法」百元有找:吃飽又省錢